甲嘧磺隆对斑马鱼早期发育阶段的影响
Effects of sulfometuron-methyl on zebrafish at early developmental stages(标题:嘧磺隆对斑马鱼早期发育的影响)
abstract(摘要)
purpose: 在本研究中,利用斑马鱼来评估SM对水生脊椎动物的有害影响。
the general method of the experiment(实验大致方法): 在受精后5.5 ~ 72 h,将斑马鱼胚胎分别暴露于0、10、20和40 mg/L的SM中。
result(结果):
- 10、20和40 mg/L SM处理组斑马鱼仔鱼死亡率上升,孵化率降低。
- SM暴露后,观察到免疫细胞(中性粒细胞和巨噬细胞)数量以剂量依赖性方式减少。
- SM暴露后,观察到免疫细胞(中性粒细胞和巨噬细胞)数量以剂量依赖性方式减少。
- SM处理显著增加了斑马鱼仔鱼在光暗转换过程中的总距离、平均速度和最大加速度,随后的酶学测试也显示了相同的趋势。
- 在氧化应激条件下,各处理组ROS水平均显著升高。
- 20、40 mg/L组细胞凋亡明显增加,高浓度组p53、Bax/Bcl-2、caspase-9、caspase-3等凋亡相关基因表达显著增加(P < 0.001)
- 抗炎因子(IL-10 和 TGF-β )在所有处理组中均下调,且在 40 毫克 / 升暴露组中发生显著变化。
conclusion(结论): 暴露于 SM 会对斑马鱼早期发育阶段的发育、免疫系统、运动行为、氧化应激和细胞凋亡产生毒性作用
Report Requirements(汇报要求)
- 背景知识
- 实验结果 (要求讲解文章里的图片结果)
- 分析与讨论
- 给我的启发 (文章存在的不足、解决思路、实验方案设计等….)
Notes on the paper(关于论文的笔记)
- 简介:
- SM: 磺酰脲类除草剂(在巴西广泛使用,甘蔗的杂草防治)
- 优点:
- 抑制阔叶杂草和禾本科杂草的生长
- 苗期后的草本杂草控制
- 非光合抑制剂,抑制高等植物、酵母和细菌的生长(选择性抑制乙酰乳酸合成酶的活性来实现的,而该酶在支链氨基酸生物合成中起着至关重要的作用)
- 缺点:
- 环境污染
- 对绿肥品种有植物毒性,且在土壤中有较长的存留活性。
- SM暴露 可以改变突土壤生物群落组成,导致生态环境显著变化
- 水中检测到的SM浓度可达0.020μg/L,对水生生物有害。
- SM处理的硬骨鱼在相关环境浓度下,肌肉组织中的乙酰胆碱酶活性显著增加。
- 人们对SM暴露的危害特征了解较少,需要加强对生物体的毒理学研究,有利于风险评估。
- 斑马鱼(毒素生态学研究的杰出模型)
- 优点
- 胚胎透明、体积小、繁殖力强、时代时间短、易于管理。
- 斑马鱼的同源物在序列和功能上与人类高度相似。
- 斑马鱼胚胎可以评估环境污染物对神经行为、免疫学、心血管系统和氧化应激等方面的内影响。
- 本文章斑马鱼的利用(早期发育阶段)
- 发育
- 免疫系统
- 运行行为
- 氧化应激
- 细胞凋亡
堆斑马鱼的影响:
- 增加斑马鱼幼鱼的死亡率并降低其孵化能力。
- 免疫细胞(中性粒细胞和巨噬细胞)数量显著减少,炎症反应(TLR4、MYD88、IL-1β、IL-6、IL-8、IFN-γ、IL-10 和 TGF-β )也发生了显著改变。因此,接触甲嘧磺隆会导致免疫系统受损。
- 斑马鱼对明暗转换的运动行为(总移动距离、平均速度和最大加速度)被激活,这一现象可以通过乙酰胆碱酯酶活性的增加来解释。
- 所有处理组的活性氧(ROS)水平均显著升高,表明存在对甲嘧磺隆的氧化应激反应。
- 包括 p53、Bax/Bcl-2、caspase-9 和 caspase-3 等凋亡相关基因显著上调,这或许是导致凋亡细胞数量增加的原因
结论: 接触甲嘧磺隆有可能在斑马鱼早期发育阶段引起免疫毒性、行为改变、氧化应激和细胞凋亡。
材料与方法
2.1化学试剂
- 甲嘧磺隆(CAS 编号 74222-97-2,分析标准纯度大于 98%)
- 酶促抗氧化剂(活性氧、过氧化氢酶、超氧化物歧化酶和丙二醛)
- TRIzol 试剂(TransZol Up,ET111-01)
- 逆转录试剂盒(EasyScript® 一步法去除基因组 DNA 及 cDNA 合成预混液,AE311-02)
- 荧光定量 PCR 试剂盒(TransStart® Tip Green 荧光定量 PCR 预混液,AQ141-02)
- 吖啶橙(CAS:10127-02-3)
- 考马斯亮蓝标准品
- 其他分析纯试剂
2.2斑马鱼的饲养与胚胎收集
- 野生型 AB 品系和转基因品系(Tg (lyz:DsRed) 和 Tg (Rag2:DsRed),中国斑马鱼资源中心
- 成年斑马鱼饲养在中国上海海圣生物实验设备有限公司的自动连续流水养殖系统中:
- 水温保持在 28±1℃
- 光照周期为 14 小时光照
- 10 小时黑暗
- 受精卵由成年斑马鱼自然产卵获得
- 在 28℃下于 E3 胚胎培养液(5 mM 氯化钠、0.17 mM 氯化钾、0.33 mM 氯化钙、0.33 mM 硫酸镁,pH 7.4)中进行孵化。
- 所有动物实验均按照相关指南进行,并获得了中国国家食品药品监督管理总局实验动物使用与管理的批准。
2.3甲嘧磺隆暴露实验
- 甲嘧磺隆(SM)的 10 g/L 母液用二甲基亚砜(DMSO)配制,并保存在 4℃下。
- 对于 AB 品系和转基因品系(Tg (lyz:DsRed)),受精后 5.5 小时(hpf)的健康胚胎随机转移到 6 孔培养板中(每孔 20 个胚胎)。
- 处理组分别在受精后 5.5 小时至 72 小时暴露于 10、20 或 40 mg/L 的甲嘧磺隆中,而对照组仅接受 DMSO(溶剂,0.1%)。
- 转基因品系 Tg (Rag2:DsRed) 在受精后 72 至 144 小时用不同终浓度的甲嘧磺隆(10、20 和 40 mg/L)处理,以检测斑马鱼幼鱼的适应性免疫毒性。
- 在暴露期间,每天更换甲嘧磺隆溶液,并在受精后 24、48、72 和 96 小时统计累计死亡率。此外,在受精后 72 小时计算孵化率。在胚胎发育过程中使用 1 - 苯基 - 2 - 硫脲(PTU)抑制黑色素生成。使用德国徕卡 M205 FA 体视显微镜采集显微图像。为保证实验目的相同,在整个实验过程中显微参数保持恒定。
2.4甲嘧磺隆实际浓度的测定
- 在暴露试验开始后,于受精后 5.5、24、48 和 72 小时,在每天上午 9 点更换溶液前采集水样。甲嘧磺隆的实际浓度按照塞韦罗等人(2020)描述的方法进行分析。简而言之,从 10、20 或 40 mg/L 组收集的暴露溶液用纯水稀释。预处理后的样品直接注入高效液相色谱 - 二极管阵列检测(HPLC-DAD)系统进行定量分析。甲嘧磺隆的定量分析使用德国安捷伦科技公司的 Agilent 1260 Infinity II 液相色谱系统,配备泵:G7104C 1260 灵活泵;进样器:G7129C 1260 小瓶进样器;色谱柱:Agilent Poroshell 120 EC-C18,2.1×50 mm,1.9 µm;紫外检测器:二极管阵列检测器(G7117C 1260 DAD HS,波长 234 nm)。为测定实际浓度,采用等度洗脱进行色谱分离,流动相为甲醇:水 = 80:20(V/V)的混合溶液,流速为 0.5 mL/min,温度为 25℃。进样体积为 5 μL。
2.5氧化应激检测
- 为检测对甲嘧磺隆的氧化应激反应,首先在受精后 72 小时测量活性氧(ROS)水平(徐等人,2020)。为定量 ROS 的产生,将胚胎在 28℃下于 20 μM 二氯二氢荧光素二乙酸酯(DCFH-DA,E004)中黑暗孵育 60 分钟(陈等人,2020)。然后,用 E3 培养液清洗斑马鱼胚胎,直至去除残留的探针(徐等人,2020)。使用德国徕卡 M205 FA 体视显微镜拍摄 ROS 积累的照片。通过 ImageJ 软件(与 Java 1.8.0_172 捆绑的 ImageJ)对 ROS 产生的荧光强度进行定量分析。
- 此外,还检测了超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性以及丙二醛(MDA)的水平。每组使用 40 个斑马鱼胚胎提取总蛋白。总蛋白用考马斯亮蓝染色,然后用美国珀金埃尔默公司的 VICTOR Nivo 多功能酶标仪(沃尔瑟姆,美国)测量其含量。SOD(货号 A001-1-1)和 CAT(货号 A007-1)的活性以及 MDA 水平(货号 A003-2-1)使用相应的检测试剂盒(南京建成生物工程研究所)进行测定。用美国珀金埃尔默公司的多功能酶标仪检测吸光度,每个样品重复测量三次。
- 表格
| 对比项目 | 处理组 | 对照组 |
|---|---|---|
| 实验对象 | AB 品系和转基因品系(Tg (lyz:DsRed))受精后 5.5 小时(hpf)的健康胚胎;转基因品系 Tg (Rag2:DsRed) 的胚胎 | AB 品系和转基因品系(Tg (lyz:DsRed))受精后 5.5 小时(hpf)的健康胚胎 |
| 使用试剂 | 10、20 或 40 mg/L 的甲嘧磺隆;不同终浓度的甲嘧磺隆(10、20 和 40 mg/L)(用于 Tg (Rag2:DsRed)) | 仅接受 DMSO(溶剂,0.1%) |
| 处理时间 | AB 品系和 Tg (lyz:DsRed):受精后 5.5 小时至 72 小时;Tg (Rag2:DsRed):受精后 72 至 144 小时 | (Rag2:DsRed):受精后 72 至 144 小时 与处理组 AB 品系和 Tg (lyz:DsRed) 时间相同(受精后 5.5 小时至 72 小时) |
| 观察指标 | 累计死亡率(受精后 24、48、72 和 96 小时统计)、孵化率(受精后 72 小时计算)、适应性免疫毒性(针对 Tg (Rag2:DsRed)) | 累计死亡率(受精后 24、48、72 和 96 小时统计)、孵化率(受精后 72 小时计算) |
| 其他操作 | 每天更换甲嘧磺隆溶液;使用 1 - 苯基 - 2 - 硫脲(PTU)抑制黑色素生成;使用德国徕卡 M205 FA 体视显微镜采集显微图像且整个实验过程中显微参数保持恒定 | 每天更换 DMSO 溶液;使用 1 - 苯基 - 2 - 硫脲(PTU)抑制黑色素生成;使用德国徕卡 M205 FA 体视显微镜采集显微图像且整个实验过程中显微参数保持恒定 |
2.6细胞凋亡检测
- 甲嘧磺隆(SM)暴露对胚胎细胞凋亡的影响是通过吖啶橙(AO)染色来确定的,吖啶橙是一种能检测凋亡细胞的异染性染料。
- 在暴露于不同剂量的甲嘧磺隆(10、20 和 40 mg/L)后,在受精后 3 天(3 dpf)统计每组斑马鱼幼鱼中的凋亡细胞数量。
- 幼鱼在 E3 培养液中清洗两次,然后转移至 2.5 mg/mL 的吖啶橙溶液中,在 28℃黑暗条件下孵育 30 分钟
- 用胚胎培养液将染色后的幼鱼冲洗三次,再使用德国徕卡 M205 FA 体视显微镜拍照。凋亡细胞会呈现出绿色荧光斑点,通过 ImageJ 软件计算这些斑点数量,以此来表示细胞凋亡水平
2.7先天性和适应性免疫细胞分析
- 实验目的:描述甲嘧磺隆暴露在斑马鱼幼鱼中诱导的先天性和适应性免疫毒性。
实验设计:对用 0、10、20、40 mg/L 的甲嘧磺隆处理的转基因品系进行剂量依赖性测试 。 - 先天性免疫细胞分析
- 中性粒细胞检测:将受精后 5.5 小时(hpf)的 Tg (lyz:DsRed) 胚胎暴露于不同剂量甲嘧磺隆,在受精后 3 天(3 dpf)麻醉鱼,于徕卡荧光显微镜下检测尾造血组织(CHT)中标记红色荧光的中性粒细胞数量;同时采用苏丹黑染色法辅助观察,先对胚胎做相同前期处理,用 4% 多聚甲醛 4℃固定过夜,再染色拍照。
- 巨噬细胞检测:将受精后 72 小时(72 hpf)的幼鱼浸泡在 2.5 μg/mL 的中性红溶液中,通过徕卡 M205 FA 荧光显微镜记录位于幼鱼背脑部位的巨噬细胞,定量分析甲嘧磺隆处理后其分布情况。
- 适应性免疫细胞分析:利用转基因品系 Tg (Rag2:DsRed),其胸腺细胞呈现红色荧光。在受精后 72 小时至 6 天(6 dpf)对胚胎进行甲嘧磺隆暴露处理,使用德国徕卡 TCS SP8 激光扫描共聚焦显微镜采集图像并处理,通过 ImageJ 软件计算胸腺细胞的总荧光面积,比较处理组和对照组在胸腺发育方面的差异,探究甲嘧磺隆暴露对适应性免疫反应的影响.
2.8荧光定量逆转录聚合酶链式反应(qRT-PCR)分析
- 总 RNA 提取:在受精后 72 小时,依据制造商方案,使用 TRIzol 试剂从每组约 20 条斑马鱼幼鱼中提取总 RNA(参考熊等人,2019 的研究)。
- RNA 质量评估:运用美国赛默飞世尔科技公司的 NanoDrop OneC 分光光度计,通过测定光密度比值 OD260/OD280 来评估提取的 RNA 质量。该比值可反映 RNA 的纯度,一般纯 RNA 的 OD260/OD280 比值在 1.8 - 2.0 之间 ,若比值偏离此范围,可能存在蛋白质或其他杂质污染。
- 逆转录:取 1 微克提取的 RNA,使用美国赛默飞世尔科技公司 Applied Biosystems 的 SimpliAmp™热循环仪,以 oligo-dT 为引物进行逆转录,将 RNA 逆转录为互补 DNA(cDNA),为后续的 qRT-PCR 分析做准备。
- qRT-PCR 分析:在德国耶拿分析仪器股份公司的 qTOWER 3 G 上进行荧光定量实时聚合酶链式反应分析。以 β- 肌动蛋白(β-actin)管家基因为参考基因,所有待检测基因的引物信息列于补充表 S1。数据以特定形式(文中未完整给出,推测为与对照组和处理组相关的标准化数据形式)呈现,每个实验至少重复三次,以此保证实验结果的可重复性和可靠性。
- 总结:该部分主要介绍了从斑马鱼幼鱼提取总 RNA,经质量评估、逆转录后,进行 qRT-PCR 分析的一系列实验操作步骤,明确了各步骤使用的仪器、试剂及数据处理原则,旨在通过检测相关基因表达量,研究甲嘧磺隆对斑马鱼幼鱼的影响,且通过多次重复实验确保结果科学可信。
2.9 幼鱼行为学检测
- 实验前准备:将受精后 6 天(6 dpf)的幼鱼以与上述实验相同的浓度梯度暴露于甲嘧磺隆中,暴露时长为 24 小时。
- 运动行为测试
- 幼鱼安置:随机选取斑马鱼幼鱼,分别转移至 48 孔板,每孔加入 800 μL E3 培养液。
- 适应与刺激:让幼鱼适应光照刺激 10 分钟,随后使其暴露于交替的光照和黑暗周期(持续光照 5 分钟,黑暗处理 5 分钟,持续光照 5 分钟,黑暗处理 5 分钟)。
- 数据记录与处理:使用荷兰诺达思信息技术公司的 Daniovision 观察室记录幼鱼运动行为,进行自动跟踪研究,并借助 EthoVision XT 10.0 软件处理运动活动数据。
- 生化检测:根据试剂盒制造商的说明,从每组中收集 40 多条经甲嘧磺隆处理的幼鱼,用于检测乙酰胆碱酯酶(AChE)活性,该检测所用试剂盒货号为 A024–1–1,由南京建成生物工程研究所提供。
- 总结:该部分内容主要介绍了斑马鱼幼鱼行为学检测实验,包括实验前对幼鱼进行甲嘧磺隆暴露处理,实验中让幼鱼经历光照适应和光暗交替刺激,通过专业设备和软件记录并处理幼鱼运动行为数据,同时对部分幼鱼进行乙酰胆碱酯酶活性的生化检测,旨在探究甲嘧磺隆对斑马鱼幼鱼运动行为及相关生理指标的影响。
2.10 统计分析
考虑到不同胚胎对甲嘧磺隆处理的反应存在差异,所有数值均以至少三个独立实验的平均值 ± 标准差(S.D.)表示。使用 GraphPad Prism 8 软件进行数据分析。采用单因素方差分析(ANOVA)后进行邓尼特检验,当 p 值≤0.05 时定义为具有统计学显著差异,用星号表示:(P < 0.05),(P < 0.01)或(P < 0.001)。
结果
- 甲嘧磺隆暴露诱导的发育毒性
- 实验设计:为探究甲嘧磺隆对水生生态系统潜在的发育毒性,将受精后 5.5 小时(hpf)的斑马鱼胚胎暴露于不同剂量的甲嘧磺隆。
- 结果呈现:通过图 1B 展示多个发育阶段(受精后 24 - 96 小时)的存活率,发现甲嘧磺隆暴露使斑马鱼胚胎死亡率呈浓度依赖性增加;图 1C 显示,与对照组相比,所有浓度处理组均出现孵化延迟。
- 结论:甲嘧磺隆对斑马鱼表现出剂量依赖性的发育毒性。
- 甲嘧磺隆暴露诱导斑马鱼免疫稳态失调
- 免疫细胞数量检测
- 中性粒细胞:使用转基因斑马鱼 Tg (lyz:DsRed) 标记中性粒细胞,测量尾造血组织(CHT)区域的数量,发现受精后 72 小时(72 hpf)不同浓度甲嘧磺隆处理组的中性粒细胞数量较对照组急剧下降,且苏丹黑染色结果验证了这一趋势。
- 巨噬细胞:在受精后 72 小时(72 hpf),对幼鱼背脑区域用中性红染色,统计巨噬细胞数量,结果显示甲嘧磺隆暴露导致巨噬细胞数量呈剂量依赖性显著减少。
- 胸腺细胞:利用转基因品系 Tg (rag2:DsRed) 观察胸腺细胞,发现暴露于甲嘧磺隆后胸腺面积无明显变化 。
- 免疫相关基因转录水平检测:测量免疫相关基因(TLR4、MYD88、IL-1β、IL-6、IL-8、IFN-γ、IL-10 和 TGF-β)的转录水平,qRT-PCR 分析表明,TLR4/MyD88 通路和促炎细胞因子(IL-6、IL-8 和 IFN-γ)显著增加。
- 结论:甲嘧磺隆暴露会诱导斑马鱼免疫稳态失调,对免疫细胞数量和免疫相关基因转录水平产生影响。
- 免疫细胞数量检测
- 总结:该部分结果表明,甲嘧磺隆暴露对斑马鱼具有明显的发育毒性,会导致胚胎死亡率上升、孵化延迟;同时还会诱导斑马鱼免疫稳态失调,使中性粒细胞和巨噬细胞数量呈剂量依赖性减少,虽然胸腺面积未因甲嘧磺隆暴露发生明显变化,但免疫相关基因中 TLR4/MyD88 通路和部分促炎细胞因子的转录水平显著增加。
3.1甲嘧磺隆暴露诱导的发育毒性
- 毒性研究对象及方式:明确研究对象为甲嘧磺隆对斑马鱼胚胎的发育毒性,方式是将受精后 5.5 小时(hpf)的斑马鱼胚胎暴露于不同剂量的甲嘧磺隆。
- 结果呈现
通过图 1B 展示受精后 24 - 96 小时多个发育阶段胚胎存活率,指出甲嘧磺隆暴露使斑马鱼胚胎死亡率呈浓度依赖性增加。
依据图 1C 表明与对照组相比,所有甲嘧磺隆处理组均出现孵化延迟现象。 - 结论:得出甲嘧磺隆对斑马鱼表现出剂量依赖性发育毒性的结论。
- 总结
为探究甲嘧磺隆对水生生态系统潜在发育毒性,对受精后 5.5 小时的斑马鱼胚胎进行不同剂量甲嘧磺隆暴露处理。通过图 1B 和图 1C 呈现结果,发现其会使斑马鱼胚胎死亡率随剂量增加而上升,且导致孵化延迟,最终得出甲嘧磺隆对斑马鱼具有剂量依赖性发育毒性的结论.
3.2 甲嘧磺隆暴露诱导斑马鱼免疫稳态失调
- 实验目的:本研究旨在评估甲嘧磺隆的免疫毒性,通过对斑马鱼免疫细胞数量和免疫相关基因转录水平进行检测来展开研究
- 免疫细胞数量检测
- 中性粒细胞:使用转基因斑马鱼 Tg (lyz:DsRed) 标记尾造血组织(CHT)区域的中性粒细胞并计数,发现受精后 72 小时(72 hpf)不同浓度甲嘧磺隆处理组较对照组数量急剧下降;还用苏丹黑染色法再次测量验证,结果趋势一致。
- 巨噬细胞:在受精后 72 小时(72 hpf),用中性红染色幼鱼背脑区域来获取巨噬细胞数量,发现甲嘧磺隆暴露使其呈剂量依赖性显著减少。
- 胸腺细胞:利用转基因品系 Tg (rag2:DsRed) 观察胸腺细胞,发现暴露于甲嘧磺隆后胸腺面积无明显变化。
- 免疫相关基因转录水平检测:检测免疫相关基因(TLR4、MYD88、IL - 1β、IL - 6、IL - 8、IFN - γ、IL - 10 和 TGF - β )转录水平,qRT - PCR 分析显示 TLR4/MyD88 通路和部分促炎细胞因子(IL - 6、IL - 8 和 IFN - γ )显著增加。
- 结论:甲嘧磺隆暴露诱导斑马鱼免疫稳态失调。
- 总结
为评估甲嘧磺隆免疫毒性,对斑马鱼免疫细胞数量和免疫相关基因转录水平进行检测。在免疫细胞方面,用不同方法发现甲嘧磺隆使中性粒细胞和巨噬细胞数量减少,而胸腺细胞面积无明显变化;在基因转录水平上,qRT - PCR 分析表明部分通路和促炎细胞因子显著增加。综合表明甲嘧磺隆暴露会诱导斑马鱼免疫稳态失调。
3.3 甲基磺草酮处理诱导的神经毒性
- 实验方法:利用 DanioVision 观察腔室系统,在 SM 暴露 24 小时后,监测受精后 7 天(7 dpf)斑马鱼幼体在明暗光周期刺激下的运动行为。
- 实验结果:与对照组相比,所有 SM 处理组在明暗光周期下的总移动距离、平均速度和最大加速度均增加,运动活性提高,呈现多动行为。同时,暴露于 SM 后乙酰胆碱酯酶(AChE)活性大幅增加,10 mg/L 浓度组活性最高。
- 结论:SM 改变幼体运动行为,可能通过激活 AChE 活性促进神经信号转导。
3.4 SM 诱导氧化应激
- 实验方法:在受精后 72 小时(72 hpf),定量检测经 SM 处理后的斑马鱼活性氧(ROS)、丙二醛(MDA)含量,以及超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性 。
- 实验结果:随着 SM 暴露剂量增加,细胞内 ROS 产生显著增加,主要在肠道、心脏和大脑积累,引发氧化应激。SOD 和 CAT 活性显著增加,MDA 水平先升高后降低。
- 结论:斑马鱼经 SM 处理后氧化应激水平显著升高。
3.5 SM 对细胞凋亡的影响
- 实验方法:受精后 72 小时,通过吖啶橙染色观察暴露于 SM 的胚胎,并评估凋亡相关基因(p53、Bax、Bcl - 2、caspase9 和 caspase3)的转录水平。
- 实验结果:大量凋亡细胞集中在头部,尤其在最高剂量组。40 mg/L 浓度组受精后 72 小时时,p53、Bax、caspase - 9 和 caspase - 3 表达水平显著上调,Bax/Bcl - 2 比值有统计学意义。
- 结论:胚胎期 SM 诱导细胞凋亡,在头部显著富集,与 p53、Bax/Bcl - 2 和 caspase 通路相关。
讨论
- 研究背景:甲基磺草酮(SM)作为苗后除草剂,毒理学特性不明,对水生动物毒理学评估意义重大,斑马鱼是毒理学评估重要模型。
- 对斑马鱼的毒性影响:
- 发育毒性:胚胎发育早期,SM 暴露增加死亡率,导致幼体孵化延迟。
- 免疫毒性:利用转基因斑马鱼结合染色观察,发现 SM 使头部 - 胸腺区域中性粒细胞和头部巨噬细胞数量剂量依赖性减少,抑制先天性免疫细胞形成;炎症相关因子 mRNA 表达变化,抗炎因子表达下调,致免疫稳态失调。
- 神经毒性:与其他农用化学品类似,SM 暴露增加斑马鱼幼体运动活性,通过激活 AChE 活性产生神经毒性,促进运动能力。
- 氧化应激:SM 处理使斑马鱼 ROS 在肠道、心脏和大脑积累,SOD 和 CAT 活性提高,MDA 水平先升后降,诱导氧化应激,抗氧化酶活性提高是对氧化应激的补偿反应。
- 细胞凋亡:SM 处理通过调节 p53、Bax、Bax/Bcl - 2、caspase9 和 caspase3 基因表达诱导细胞凋亡。
- 研究总结:研究聚焦 SM 在斑马鱼中的综合毒性,发现其在斑马鱼生命早期造成发育、免疫、神经毒性及氧化应激和细胞凋亡,揭示其潜在风险
结论
总结实验结果,SM 处理使斑马鱼幼体死亡率增加、孵化率降低;免疫细胞数量减少,抗炎因子水平下调;增加幼体运动相关指标;诱导氧化应激,特定浓度下凋亡细胞及凋亡相关基因显著增加 。本文揭示了 SM 在斑马鱼早期发育中诱导的多种毒性,为其对水生生物影响提供新证据,强调其环境健康风险值得关注。
图片1
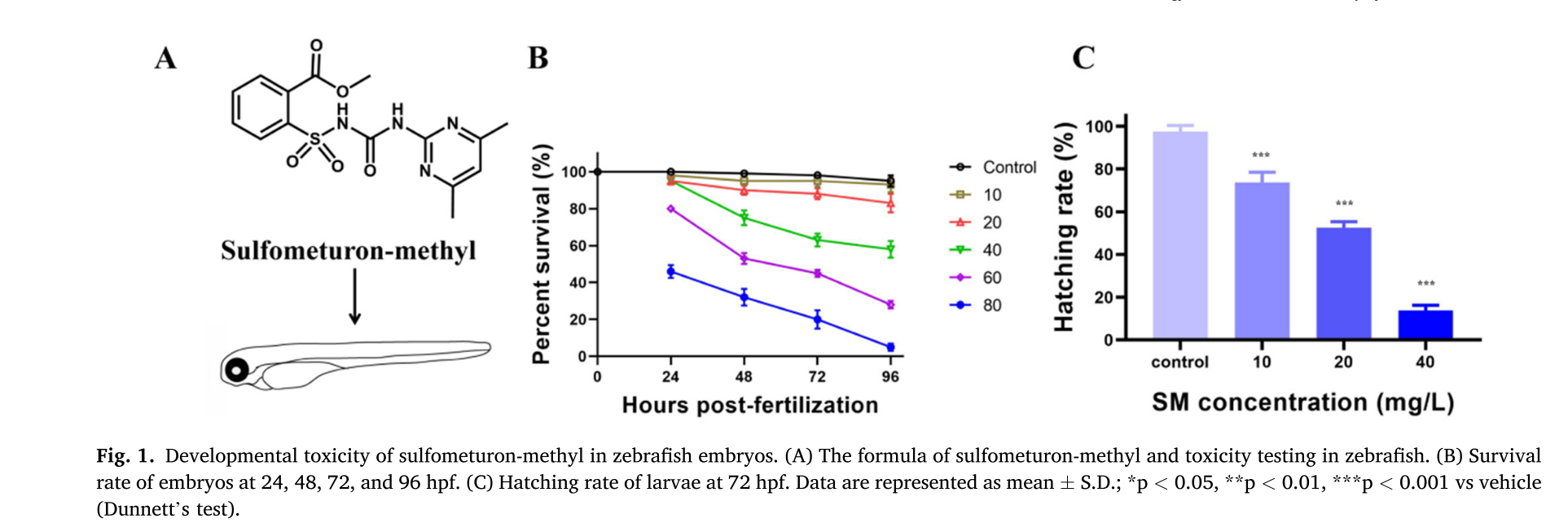 这组图展示了甲基磺草酮(Sulfometuron - methyl)对斑马鱼胚胎的发育毒性研究
## A部分
呈现了甲基磺草酮的化学结构式 ,并示意对斑马鱼进行毒性测试,甲基磺草酮是一种磺酰脲类除草剂,通过抑制乙酰乳酸合成酶(ALS),阻碍支链氨基酸合成,进而影响杂草生长 。
这组图展示了甲基磺草酮(Sulfometuron - methyl)对斑马鱼胚胎的发育毒性研究
## A部分
呈现了甲基磺草酮的化学结构式 ,并示意对斑马鱼进行毒性测试,甲基磺草酮是一种磺酰脲类除草剂,通过抑制乙酰乳酸合成酶(ALS),阻碍支链氨基酸合成,进而影响杂草生长 。
B部分
是斑马鱼胚胎在受精后 24、48、72 和 96 小时(hpf)的存活率折线图。不同颜色线条代表不同浓度处理组(10、20、40、60、80 等,单位 mg/L ),对照组(Control)存活率始终接近 100%,随着浓度增加及时间推移,各处理组存活率下降,说明甲基磺草酮浓度越高、处理时间越长,对斑马鱼胚胎存活抑制作用越明显 。
C部分
为受精后 72 小时(hpf)斑马鱼幼体孵化率柱状图。随着甲基磺草酮(SM)浓度(10、20、40 mg/L )升高,孵化率显著降低,与对照组相比,各处理组差异显著(***p < 0.001 ),表明甲基磺草酮对斑马鱼胚胎孵化有抑制作用,且浓度越高抑制越强烈 。
sulfometuron - methyl:甲基磺草酮
hours post - fertilization:受精后小时数
SM concentration:甲基磺草酮(Sulfometuron - methyl )浓度
hatching rate:孵化率
percent survival:存活率
图片2
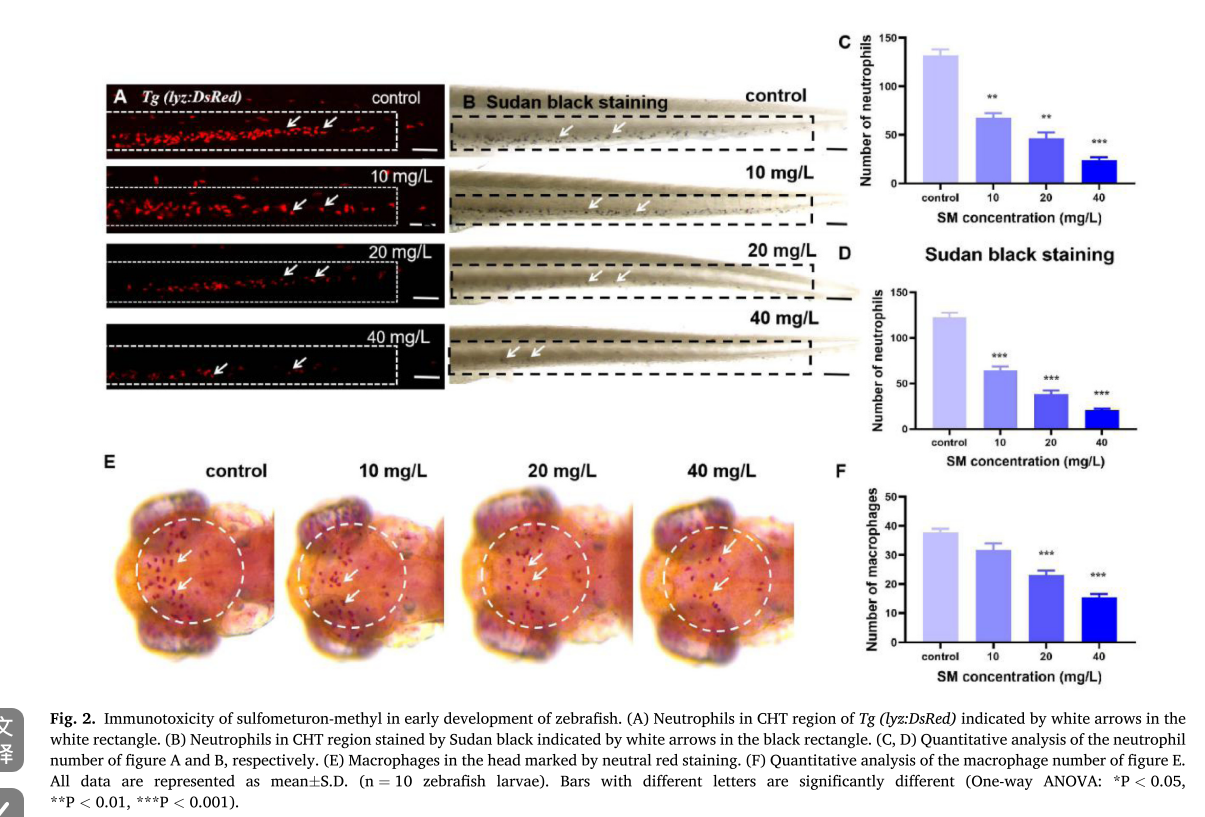 这组图展示了甲基磺草酮(sulfometuron - methyl,SM)对斑马鱼早期发育的免疫毒性研究
## A部分
利用转基因斑马鱼 Tg (lyz:DsRed) ,通过红色荧光标记显示头部 - 胸腺区域(CHT)的中性粒细胞,白色箭头指示中性粒细胞位置。可观察到随 SM 浓度(10、20、40 mg/L )升高,荧光标记的中性粒细胞数量减少。
这组图展示了甲基磺草酮(sulfometuron - methyl,SM)对斑马鱼早期发育的免疫毒性研究
## A部分
利用转基因斑马鱼 Tg (lyz:DsRed) ,通过红色荧光标记显示头部 - 胸腺区域(CHT)的中性粒细胞,白色箭头指示中性粒细胞位置。可观察到随 SM 浓度(10、20、40 mg/L )升高,荧光标记的中性粒细胞数量减少。
B部分
用苏丹黑染色显示 CHT 区域的中性粒细胞,白色箭头指示中性粒细胞,同样可见随着 SM 浓度增加,中性粒细胞数量减少
C和D部分
分别是对 A 和 B 图中中性粒细胞数量的定量分析柱状图。结果显示,与对照组相比,不同浓度 SM 处理组中性粒细胞数量显著降低(*p < 0.05,**p < 0.01,***p < 0.001 ) ,且浓度越高,数量减少越明显。
E部分
通过中性红染色标记斑马鱼头部的巨噬细胞,白色箭头指示巨噬细胞位置,可看出随 SM 浓度升高,巨噬细胞数量有减少趋势 。
F部分
是对 E 图中巨噬细胞数量的定量分析柱状图。与对照组相比,各 SM 处理组巨噬细胞数量显著降低(*p < 0.05,**p < 0.01,***p < 0.001 ) ,表明甲基磺草酮对斑马鱼早期发育中的巨噬细胞数量有抑制作用,且浓度越高抑制作用越强。
图片3
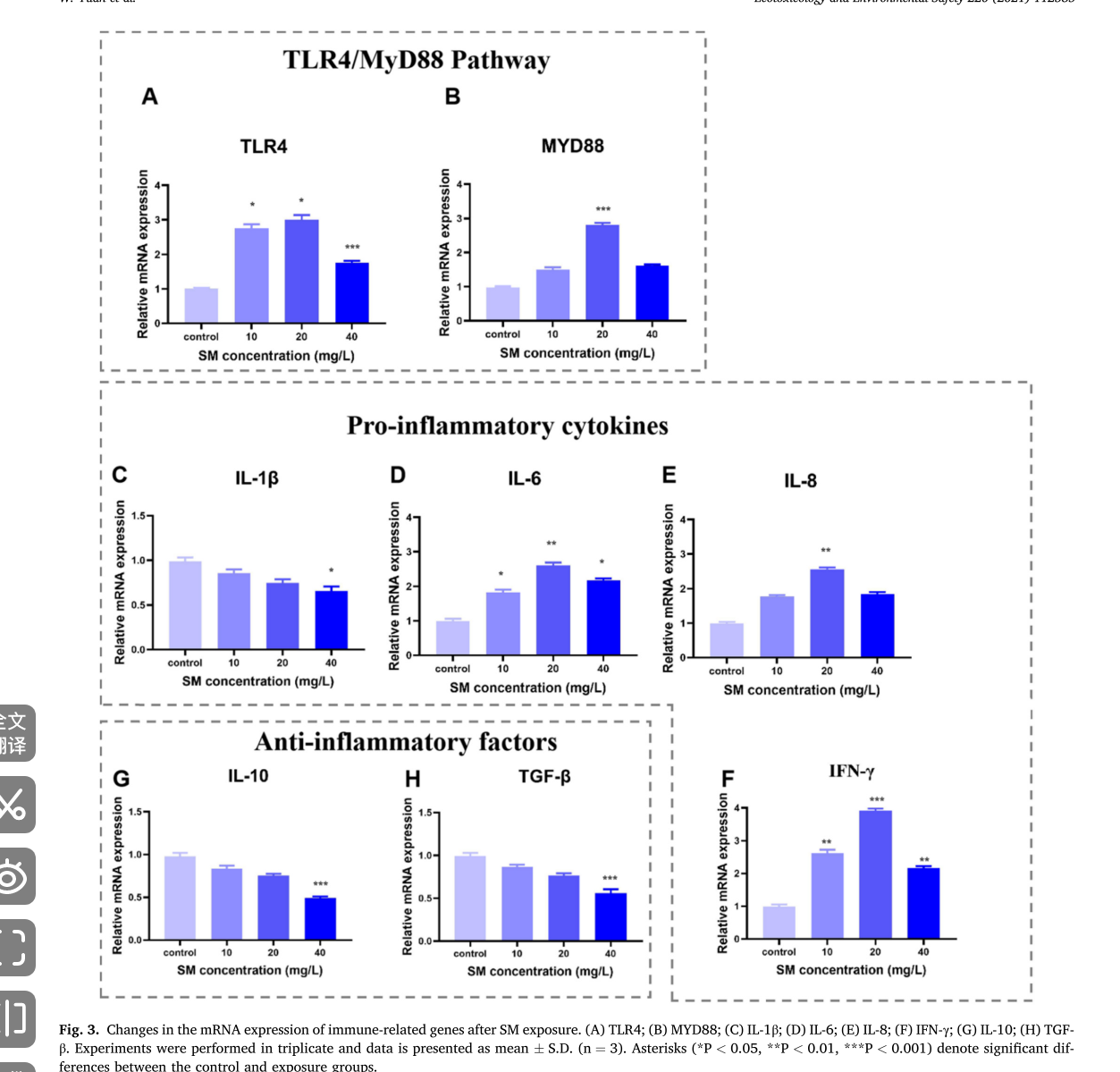 这组柱状图(Fig. 3)展示了暴露于甲基磺草酮(SM)后,斑马鱼免疫相关基因 mRNA 表达的变化情况
这组柱状图(Fig. 3)展示了暴露于甲基磺草酮(SM)后,斑马鱼免疫相关基因 mRNA 表达的变化情况
TLR4/MyD88 通路相关基因
- A 图(TLR4):TLR4(Toll 样受体 4 )的相对 mRNA 表达量。与对照组相比,10 mg/L 和 20 mg/L 浓度组的表达量显著增加(分别用和表示 ),40 mg/L 浓度组虽有增加但显著性稍低(** 表示 )。说明低、中浓度 SM 可促进 TLR4 基因表达。
- B 图(MYD88):MYD88(髓样分化因子 88 )的相对 mRNA 表达量。10 mg/L 浓度组表达量有所上升,20 mg/L 浓度组显著增加(** 表示 ) ,40 mg/L 浓度组有所回落但仍高于对照组。表明 SM 对 MYD88 基因表达有浓度相关的调节作用
促炎细胞因子相关基因
- C 图(IL - 1β ):IL - 1β(白细胞介素 - 1β )的相对 mRNA 表达量在各处理组与对照组间差异不显著,说明 SM 对其表达影响较小。
- D 图(IL - 6) :IL - 6(白细胞介素 - 6 )的相对 mRNA 表达量,10 mg/L 和 20 mg/L 浓度组显著增加(分别用 * 和 ** 表示 ) ,40 mg/L 浓度组仍高于对照但显著性降低(* 表示 ) ,显示 SM 可促进 IL - 6 表达,且中低浓度时促进作用更明显。
- E 图(IL - 8):IL - 8(白细胞介素 - 8 )的相对 mRNA 表达量,20 mg/L 浓度组显著增加(** 表示 ) ,40 mg/L 浓度组有所下降但仍高于对照组,表明 SM 在一定浓度下可上调 IL - 8 表达。
- F 图(IFN - γ ):IFN - γ(干扰素 - γ )的相对 mRNA 表达量,20 mg/L 浓度组显著升高(** 表示 ) ,40 mg/L 浓度组仍高于对照(* 表示 ),说明 SM 能促进 IFN - γ 基因表达。
抗炎因子相关基因
- G 图(IL - 10):IL - 10(白细胞介素 - 10 )的相对 mRNA 表达量,40 mg/L 浓度组显著低于对照组(*** 表示 ),表明高浓度 SM 抑制 IL - 10 基因表达。
- H 图(TGF - β ):TGF - β(转化生长因子 - β )的相对 mRNA 表达量,40 mg/L 浓度组显著低于对照组(*** 表示 ) ,说明高浓度 SM 对 TGF - β 基因表达有抑制作用 。
图片4
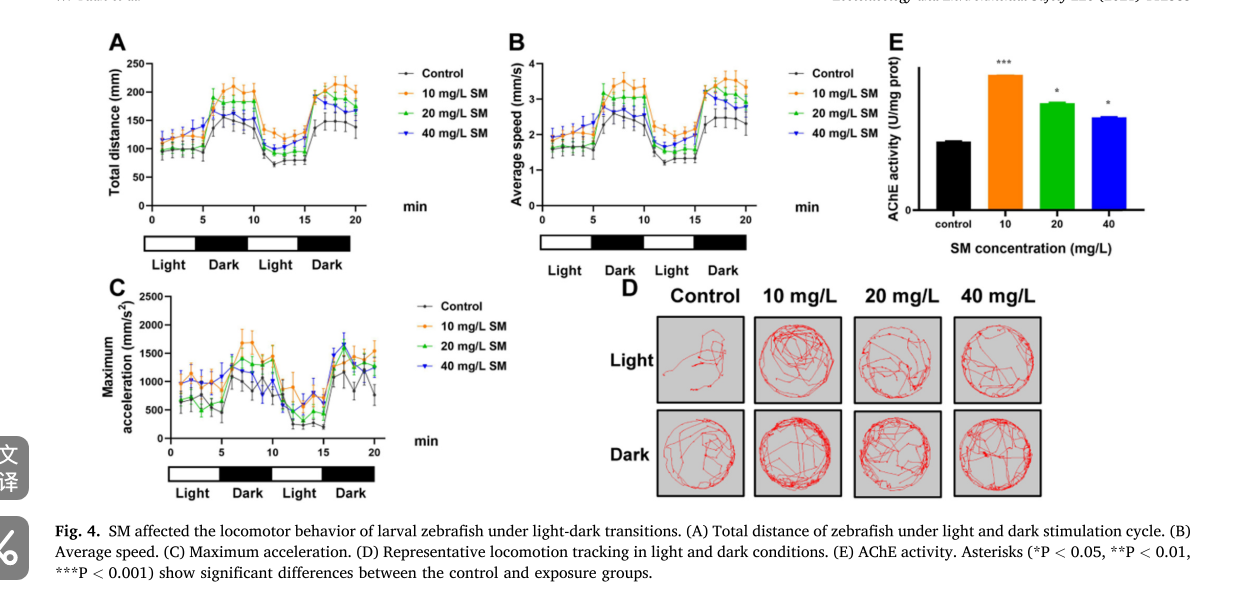 这组图(Fig. 4)展示了甲基磺草酮(SM)对斑马鱼幼体在明暗转换条件下运动行为的影响
## A - C 图
分别为斑马鱼在明暗刺激周期下的总移动距离(A 图)、平均速度(B 图)、最大加速度(C 图)。随着时间(横坐标 min)变化,在明暗交替过程中,与对照组(黑色线条 )相比,不同浓度 SM 处理组(10、20、40 mg/L )的斑马鱼幼体在总移动距离、平均速度和最大加速度上大多呈现升高趋势,说明 SM 处理可增强斑马鱼幼体在明暗条件下的运动活性。
## D 图
是在光照和黑暗条件下斑马鱼幼体的代表性运动轨迹。可看出,对照组运动轨迹相对简单,而各 SM 处理组轨迹更复杂、运动范围更大,直观体现出 SM 处理使斑马鱼幼体运动活性增加。
## E 图
为乙酰胆碱酯酶(AChE)活性。与对照组相比,各 SM 处理组 AChE 活性均显著升高(分别用 *、\**、*** 表示不同显著性水平 ),其中 10 mg/L 浓度组活性最高,表明 SM 处理可能通过激活 AChE 活性,促进神经信号转导,进而影响斑马鱼幼体运动行为。
这组图(Fig. 4)展示了甲基磺草酮(SM)对斑马鱼幼体在明暗转换条件下运动行为的影响
## A - C 图
分别为斑马鱼在明暗刺激周期下的总移动距离(A 图)、平均速度(B 图)、最大加速度(C 图)。随着时间(横坐标 min)变化,在明暗交替过程中,与对照组(黑色线条 )相比,不同浓度 SM 处理组(10、20、40 mg/L )的斑马鱼幼体在总移动距离、平均速度和最大加速度上大多呈现升高趋势,说明 SM 处理可增强斑马鱼幼体在明暗条件下的运动活性。
## D 图
是在光照和黑暗条件下斑马鱼幼体的代表性运动轨迹。可看出,对照组运动轨迹相对简单,而各 SM 处理组轨迹更复杂、运动范围更大,直观体现出 SM 处理使斑马鱼幼体运动活性增加。
## E 图
为乙酰胆碱酯酶(AChE)活性。与对照组相比,各 SM 处理组 AChE 活性均显著升高(分别用 *、\**、*** 表示不同显著性水平 ),其中 10 mg/L 浓度组活性最高,表明 SM 处理可能通过激活 AChE 活性,促进神经信号转导,进而影响斑马鱼幼体运动行为。
图片5
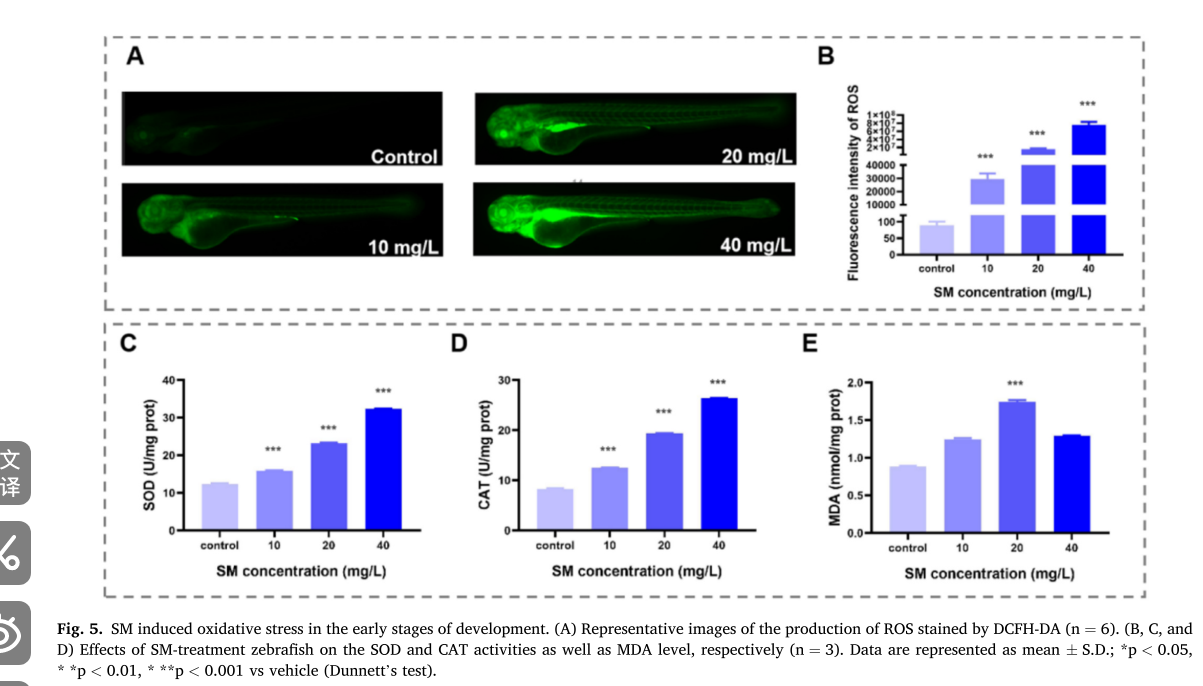 这组图(Fig. 5)展示了甲基磺草酮(SM)在斑马鱼发育早期诱导氧化应激的情况
## A - B 图
- A 图:是用 DCFH - DA 染色显示 ROS 产生的代表性图像。对照组荧光较弱,随着 SM 浓度(10、20、40 mg/L )升高,斑马鱼幼体荧光强度增强,表明 ROS 产生量增加。
- B 图:为 ROS 荧光强度定量分析柱状图。与对照组相比,各 SM 处理组 ROS 荧光强度显著升高(*** 表示 ),且呈浓度依赖性,说明 SM 可诱导斑马鱼幼体 ROS 生成增加。
## C - D 图
- C 图:展示超氧化物歧化酶(SOD)活性。随着 SM 浓度升高,SOD 活性显著增加(**、*** 表示不同显著性 ),表明 SM 处理促使斑马鱼幼体 SOD 活性上调,以应对氧化应激。
- D 图:呈现过氧化氢酶(CAT)活性。各 SM 处理组 CAT 活性较对照组显著升高(*** 表示 ),且随浓度增加而升高,说明 SM 可诱导 CAT 活性增强,增强抗氧化能力。
## E 图
为丙二醛(MDA)水平。MDA 水平随 SM 浓度升高先增加后降低,在 20 mg/L 时达到最高,表明 SM 处理初期引发脂质过氧化,MDA 水平上升,高浓度时可能因抗氧化酶激活等因素使 MDA 水平有所回落 。
这组图(Fig. 5)展示了甲基磺草酮(SM)在斑马鱼发育早期诱导氧化应激的情况
## A - B 图
- A 图:是用 DCFH - DA 染色显示 ROS 产生的代表性图像。对照组荧光较弱,随着 SM 浓度(10、20、40 mg/L )升高,斑马鱼幼体荧光强度增强,表明 ROS 产生量增加。
- B 图:为 ROS 荧光强度定量分析柱状图。与对照组相比,各 SM 处理组 ROS 荧光强度显著升高(*** 表示 ),且呈浓度依赖性,说明 SM 可诱导斑马鱼幼体 ROS 生成增加。
## C - D 图
- C 图:展示超氧化物歧化酶(SOD)活性。随着 SM 浓度升高,SOD 活性显著增加(**、*** 表示不同显著性 ),表明 SM 处理促使斑马鱼幼体 SOD 活性上调,以应对氧化应激。
- D 图:呈现过氧化氢酶(CAT)活性。各 SM 处理组 CAT 活性较对照组显著升高(*** 表示 ),且随浓度增加而升高,说明 SM 可诱导 CAT 活性增强,增强抗氧化能力。
## E 图
为丙二醛(MDA)水平。MDA 水平随 SM 浓度升高先增加后降低,在 20 mg/L 时达到最高,表明 SM 处理初期引发脂质过氧化,MDA 水平上升,高浓度时可能因抗氧化酶激活等因素使 MDA 水平有所回落 。
图片6
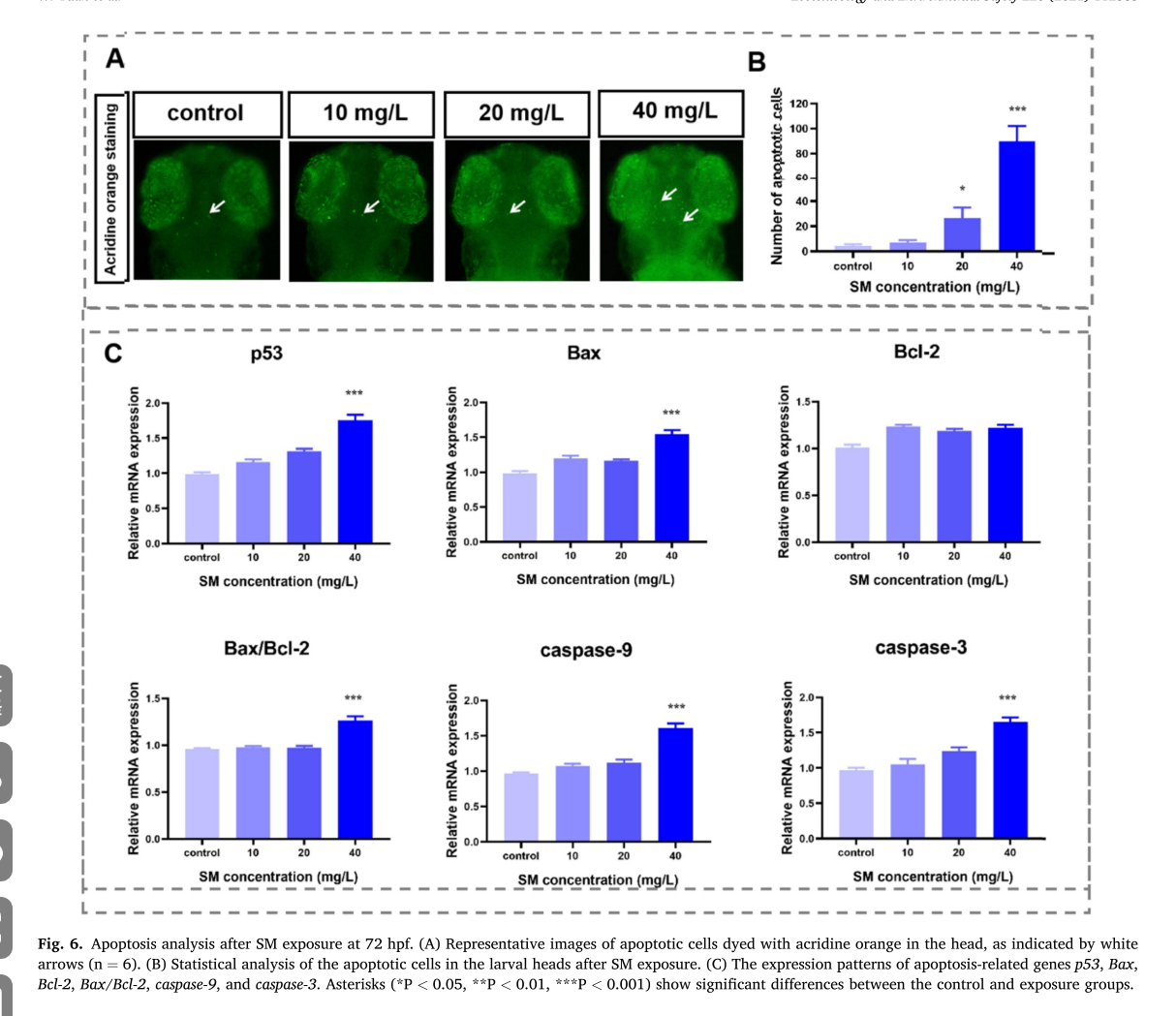 这组图(Fig. 6)展示了甲基磺草酮(SM)暴露 72 小时后对斑马鱼细胞凋亡的影响:
这组图(Fig. 6)展示了甲基磺草酮(SM)暴露 72 小时后对斑马鱼细胞凋亡的影响:
A - B 图
- A 图:用吖啶橙染色显示斑马鱼头部凋亡细胞的代表性图像,白色箭头指示凋亡细胞。可看出,随着 SM 浓度(10、20、40 mg/L )升高,头部凋亡细胞数量增多。
- B 图:对斑马鱼头部凋亡细胞数量的统计分析柱状图。与对照组相比,40 mg/L 浓度组凋亡细胞数量显著增加(*** 表示 ),表明高浓度 SM 诱导斑马鱼头部细胞凋亡。
C 图
展示凋亡相关基因的相对 mRNA 表达模式:
- p53 和 Bax:二者基因表达量随 SM 浓度升高而显著增加,40 mg/L 浓度组显著高于对照组(*** 表示 ),p53 和 Bax 是促凋亡基因,其表达上调利于细胞凋亡。
- Bcl - 2:各处理组表达量与对照组相比无显著差异,Bcl - 2 是抗凋亡基因。
- Bax/Bcl - 2:该比值在 40 mg/L 浓度组显著升高(*** 表示 ),反映促凋亡与抗凋亡作用的平衡向促凋亡方向倾斜。
- caspase - 9 和 caspase - 3:在 40 mg/L 浓度组表达量显著高于对照组(*** 表示 ),caspase 家族是细胞凋亡执行阶段关键因子,其表达上调表明 SM 诱导细胞凋亡过程中激活了相关信号通路。
参考文献
- Ahmadifar, E., Sheikhzadeh, N., Roshanaei, K., Dargahi, N., Faggio, C. 2019年。膳食生姜(姜属植物)能否改变斑马鱼(斑马鱼属)的生化和免疫参数以及与生长、免疫和抗氧化系统相关的基因表达?《水产养殖》507期,341-348页。https://doi.org/10.1016/j.aquaculture.2019.04.049。
- Assis, J.S.J.D., Tornisielo, V.L., Reis, F.C.D., Martins, B.A., Toledo, R.E.B., Filho, R.V. 2018年。甲基磺草酮在不同生长阶段甘蔗(甘蔗属)中的吸收和转运。《环境科学与健康杂志,B部分》53(11)期,746-750页。https://doi.org/10.1080/03601234.2018.1480162。
- Bartoskova, M., Dobsikova, R., Stancova, V., Zivna, D., Blahova, J., Marsalek, P., Faggio, C. 2013年。针对选定的氧化应激生物标志物评估布洛芬对斑马鱼(斑马鱼属)的毒性。《神经内分泌学快报》34(1)期,102-108页。
- Blahova, J., Cocilovo, C., Plhalova, L., Svobodova, Z., Faggio, C. 2020年。莠去津及其降解产物对斑马鱼(斑马鱼属)早期生命阶段的胚胎毒性。《环境毒理学与药理学》77期,103370。https://doi.org/10.1016/j.etap.2020.103370。
- Boldt, T.S., Jacobsen, C.S. 1998年。磺酰脲类除草剂甲磺隆、氯磺隆和噻吩磺隆对从农业土壤中分离出的荧光假单胞菌的不同毒性作用。《欧洲微生物学会联合会微生物学快报》161(1)期,29-35页。https://doi.org/10.1111/j.1574-6968.1998.tb12925.x。
- Cao, Z., Huang, Y., Xiao, J., Cao, H., Peng, Y., Chen, Z., Liu, F., Wang, H., Liao, X., Lu, H. 2020年。暴露于禾草灵甲酯会诱导斑马鱼胚胎的心脏发育毒性。《环境污染》259期,113926。https://doi.org/10.1016/j.envpol.2020.113926。
- Carles, L., Joly, M., Bonnemoy, F., Leremboure, M., Batisson, I., Besse-Hoggan, P. 2017年。由一种新型的能转化烟嘧磺隆的荧光假单胞菌菌株SG-1确定的磺酰脲类生物降解途径:毒性评估和配方的影响。《危险材料杂志》324期,184-193页。https://doi.org/10.1016/j.jhazmat.2016.10.048。
- Chen, J., Fan, R., Wang, Y., Huang, T., Shang, N., He, K., Zhang, P., Zhang, L., Niu, Q., Zhang, Q. 2020年。胚胎期用氧化铝纳米颗粒处理的成年斑马鱼的学习和记忆能力逐渐受损。《化学osphere》254期,126608。https://doi.org/10.1016/j.chemosphere.2020.126608。
- Cheng, B., Zhang, H., Hu, J., Peng, Y., Yang, J., Liao, X., Liu, F., Guo, J., Hu, C., Lu, H. 2020年。恶唑菌酮-霜脲氰诱导的斑马鱼免疫毒性和神经行为毒性。《化学osphere》247期,125870。https://doi.org/10.1016/j.chemosphere.2020.125870。
- Dai, Y.J., Jia, Y.F., Chen, N., Bian, W.P., Li, Q.K., Ma, Y.B., Pei, D.S. 2014年。斑马鱼作为研究毒理学的模型系统。《环境毒理学与化学》33(1)期,11-17页。https://doi.org/10.1002/etc.2406。
- Faria, M., Prats, E., Ramírez, J.R.R., Bellot, M., Bedrossiantz, J., Pagano, M., Raldua, D. 2021年。暴露于环境浓度的杀螟硫磷对斑马鱼幼体的雄激素激活、单胺能系统损伤和行为改变。《总体环境科学》775期,145671。https://doi.org/10.1016/j.scitotenv.2021.145671。
- Fiorino, E., Sehonova, P., Plhalova, L., Blahova, J., Svobodova, Z., Faggio, C. 2018年。草甘膦对早期生命阶段的影响:鲤鱼和斑马鱼(斑马鱼属)之间的比较。《环境科学与污染研究》25(9)期,8542-8549页。https://doi.org/10.1007/s11356-017-1141-5。
- Forn-Cuní, G., Varela, M., Pereiro, P., Novoa, B., Figueras, A. 2017年。斑马鱼和哺乳动物在急性炎症期间保守的基因调控。《科学报告》7期,41905。https://doi.org/10.1038/srep41905。
- Gholampour, T.E., Raieni, R.F., Larijani, M., Pouladi, M., Pagano, M., Faggio, C. 2020年。牡荆水醇提取物对斑马鱼(斑马鱼属)生长性能、血液生化参数、胴体品质、性别比例和性腺组织学的饮食影响。《应用科学》10(4)期,1402。https://doi.org/10.3390/app10041402。
- Guenaou, I., Hmimid, F., Lahlou, F.A., Errami, A., Irahal, I.N., Fahde, S., Ouafik, Lh, Bourhim, N. 2021年。脆弱麻黄乙酸乙酯部分对过氧化氢诱导的梨形四膜虫氧化损伤的细胞保护作用。《比较生物化学与生理学C:毒理学与药理学》239期,108899。https://doi.org/10.1016/j.cbpc.2020.108899。
- Ighodaro, O., Akinloye, O. 2018年。一线防御抗氧化剂——超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPX):它们在整个抗氧化防御体系中的基础作用。《亚历山大医学杂志》54(4)期,287-293页。https://doi.org/10.1016/j.ajme.2017.09.001。
- Jia, M., Teng, M., Tian, S., Yan, J., Meng, Z., Yan, S., Li, R., Zhou, Z., Zhu, W. 2020年。戊菌唑对映体暴露对斑马鱼(斑马鱼属)的发育毒性和神经毒性。《环境污染》267期,115450。https://doi.org/10.1016/j.envpol.2020.115450。
- Kim, E.Y., Moudgil, K.D. 2017年。促炎细胞因子对自身免疫性关节炎的免疫调节作用。《细胞因子》98期,87-96页。https://doi.org/10.1016/j.cyto.2017.04.012。
- Leandro, L.P., de Mello, R.S., da Costa-Silva, D.G., Nunes, M.E.M., Lopes, A.R., Martins, I.K., Posser, T., Franco, J.L. 2021年。暴露于代森锰锌的发育中斑马鱼的行为变化早于氧化还原改变。《环境污染》268期,115783。https://doi.org/10.1016/j.envpol.2020.115783。
- Moraes, B.S., Loro, V.L., Glusczak, L., Pretto, A., Menezes, C., Marchezan, E., de Oliveira Machado, S. 2007年。四种水稻除草剂对硬头脂鲤(一种硬骨鱼)某些代谢和毒理学参数的影响。《化学osphere》68期,1597-1601页。https://doi.org/10.1016/j.chemosphere.2007.03.006。
- Pavão, Q.S., Souza, M.D.F., Teófilo, T.M.S., Lins, H.A., Borges, M.P.S., Silva, T.S., Silva, D.V. 2021年。使用多变量分析理解甲基磺草酮在土壤中的行为。《国际环境科学与技术杂志》1-12页。https://doi.org/10.1007/s13762-021-03161-0。
- Petrovici, A., Strungaru, S.A., Nicoara, M., Robea, M.A., Solcan, C., Faggio, C. 2020年。溴氰菊酯对斑马鱼性腺的毒性通过细胞生物标志物揭示。《海洋科学与工程杂志》8(2)期,73。https://doi.org/10.3390/jmse8020073。
- Plhalova, L., Blahova, J., Divisova, L., Enevova, V., Casuscelli di Tocco, F., Faggio, C., Svobodova, Z. 2018年。亚慢性暴露于印楝素T/S对斑马鱼(斑马鱼属)的影响。《化学生态学》34(3)期,199-210页。https://doi.org/10.1080/02757540.2017.1420176。
- Plhalova, L., Sehonova, P., Blahova, J., Doubkova, V., Tichy, F., Faggio, C., Svobodova, Z. 2020年。评估盐酸曲马多对幼年斑马鱼的毒性——形态学、抗氧化和组织学反应。《应用科学》10(7)期,2349。https://doi.org/10.3390/app10072349。
- Santo, F.B., Ramos, G.A., Ricardo Filho, A.M., Marchioro, C.A., Niemeyer, J.C. 2018年。甲磺隆对跳虫和蚯蚓的筛选效应:助剂添加对生态毒性的作用。《环境科学与污染研究》25期,24143-24149页。https://doi.org/10.1007/s11356-018-2481-5。
- Sehonova, P., Tokanova, N., Hodkovicova, N., Kroupova, H.K., Tumova, J., Blahova, J., Faggio, C. 2019年。氟喹诺酮恩诺沙星在斑马鱼(斑马鱼属)中诱导的氧化应激在长期暴露后可得到改善。《环境毒理学与药理学》67期,87-93页。https://doi.org/10.1016/j.etap.2019.02.002。
- Severo, E.S., Marins, A.T., Cerezer, C., Costa, D., Nunes, M., Prestes, O.D., Zanella, R., Loro, V.L. 2020年。位于农村地区附近的巴西河流中农药污染的生态风险:一项使用斑马鱼胚胎的生物标志物研究。《生态毒理学与环境安全》190期,110071。https://doi.org/10.1016/j.ecoenv.2019.110071。
- Shen, C., Zuo, Z. 2020年。斑马鱼(斑马鱼属)作为研究危险化学品对发育、生殖、心血管、神经和眼部发育毒性的优秀脊椎动物模型。《环境科学与污染研究》27期,43599-43614页。https://doi.org/10.1007/s11356-020-10800-5。
- Sondhia, S. 2008年。甲磺隆在小麦作物和土壤中的残留情况。《环境监测与评估》147期,463-469页。https://doi.org/10.1007/s10661-007-0132-2。
- Teófilo, T.Md.S., Mendes, K.F., Fernandes, B.C.C., Oliveira, F.Sd, Silva, T.S., Takeshita, V., Souza, Md.F., Tornisielo, V.L., Silva, D.V. 2020年。绿肥植物对土壤中敌草隆、嗪草酮和甲基磺草酮的植物提取作用。《化学osphere》256期,127059。https://doi.org/10.1016/j.chemosphere.2020.127059。
- Wang, H., Zhou, L., Meng, Z., Su, M., Zhang, S., Huang, P., Jiang, F., Liao, X., Cao, Z., Lu, H. 2019年。烯禾啶暴露诱导斑马鱼生命早期的发育毒性和行为改变。《环境污染》255期,113218。https://doi.org/10.1016/j.envpol.2019.113218。
- Wei, Y., Meng, Y., Huang, Y., Liu, Z., Zhong, K., Ma, J., Zhang, W., Li, Y., Lu, H. 2021年。暴露于异菌脲对斑马鱼的发育毒性和心脏毒性。《化学osphere》263期,127860。https://doi.org/10.1016/j.chemosphere.2020.127860。
- Wessler, L.B., Farias, H.R., Ronsani, J.F., Candiotto, G., dos Santos, P.C., de Oliveira, J., Rico, E.P., Streck, E.L. 2019年。急性暴露于亮氨酸会改变斑马鱼的行为参数和胆碱能活性。《国际发育神经科学杂志》78期,222-226页。https://doi.org/10.1016/j.ijdevneu.2019.10.001。
- Weydert, C.J., Cullen, J.J. 2010年。培养细胞和组织中超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的测量方法。《自然实验指南》5期,51-66页。https://doi.org/10.1038/nprot.2009.197。
- Xiong, G., Deng, Y., Cao, Z., Liao, X., Lu, H. 2019年。荔枝草提取物对斑马鱼(斑马鱼属)的肝保护作用。《鱼类与贝类免疫学》95期,399-410页。https://doi.org/10.1016/j.fsi.2019.10.040。
- Xu, Z., Ni, H., Huang, Y., Meng, Y., Cao, Z., Liao, X., Zhang, S., Guo, X., Lu, H. 2020年。乙氧氟草醚对斑马鱼胚胎发育的影响。《化学osphere》259期,127380。https://doi.org/10.1016/j.chemosphere.2020.127380。
- Yang, T.T., Zhang, H.W., Wang, J., Li, X.Y., Li, X., Su, Z.C. 2020年。甲醇食陈港章菌CHL1菌株在盆栽实验中对甲磺隆或苯磺隆污染土壤的高生物修复潜力。《环境科学与污染研究》28期,4731-4738页。https://doi.org/10




